
Enlace químico
¿Qué es ?
Un enlace químico es la fuerza que mantiene unidos a dos o más átomos dentro de una molécula o compuesto. Se forma cuando los átomos comparten, ganan o pierden electrones para alcanzar una configuración más estable (generalmente siguiendo la regla del octeto).
¿Por qué se forman enlaces químicos?
Porque los átomos buscan estabilidad, y al unirse logran niveles de energía más bajos (más estables).
Enlace = mayor estabilidad + menor energía
Tipos de enlaces
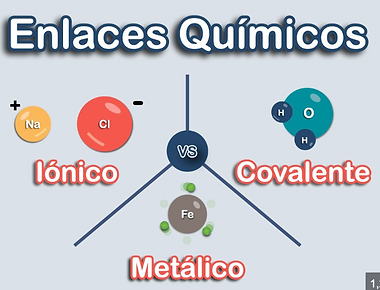
1.- Enlace IÓNICO
¿Cómo funciona?
-
Un átomo cede uno o más electrones (generalmente un metal).
-
Otro átomo los gana (generalmente un no metal).
-
Se forman iones de carga opuesta que se atraen electrostáticamente.
Propiedades:
-
Sólidos cristalinos.
-
Altos puntos de fusión y ebullición.
-
Solubles en agua.
-
Conducen electricidad en solución.
Ejemplos cotidianos
1. Sal de mesa (NaCl)
Compuesto iónico usado para cocinar, conservar alimentos y en soluciones intravenosas.
2. Tabletas antiácidas (Mg(OH)₂, CaCO₃)
Contienen iones que neutralizan el exceso de ácido estomacal.
3. Sales para descongelar calles (CaCl₂)
Funcionan porque sus iones disminuyen el punto de congelación del agua.
2.-Enlace COVALENTE
¿Cómo funciona?
-
Dos átomos comparten uno o más pares de electrones.
-
Ocurre entre no metales.
-
Comparten para que cada uno "sienta" que tiene el octeto completo.
Propiedades:
-
Pueden ser gases, líquidos o sólidos.
-
Bajos puntos de fusión.
-
No conducen electricidad.
-
Se representan con guiones:
H–O–H (un guión = un par compartido)
Tipos de enlaces covalentes:
Sencillo: Un par de electrones compartido H-H
Doble: Dos pares compartidos. O=O
Triple: Tres pares compartidos N≡N
Polar: Electrones compartidos desigualmente. H₂O
No polar: Electrones compartidos igualitariamente O₂
3.- Enlace METÁLICO
¿Cómo funciona?
-
Los átomos metálicos ceden electrones que forman una “nube electrónica” que se mueve libremente.
-
Esto mantiene unidos a los núcleos metálicos.
-
Al unirse, pierden esos electrones, formando cationes metálicos (+).
Propiedades:
-
Alta conductividad térmica y eléctrica.
-
Maleables y dúctiles.
-
Brillo metálico.
-
Sólidos (excepto el mercurio).
Ejemplos cotidianos
-
Hierro (Fe) Construcción, herramientas
-
Cobre (Cu) Cables eléctricos
-
Oro (Au) Joyería, electrónica
-
Aluminio (Al) Latas, aviones, ventanas

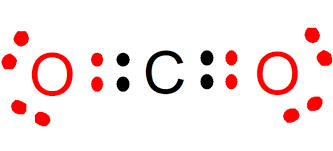




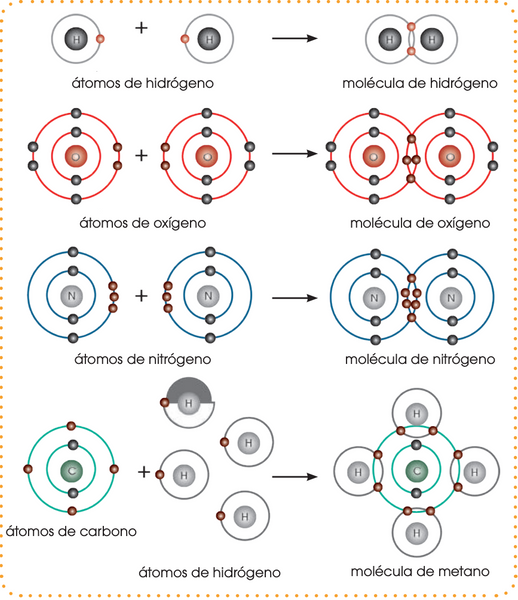
Formación de enlaces covalentes
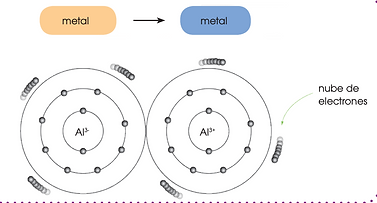
El enlace metálico es la fuerza atractiva que existe en los metales entre los iones positivos y los electrones móviles de valencia que los rodean.

Mira el siguiente video

Estructura interna de los metales
-
Los átomos de los metales no forman moléculas sino que se colocan ordenadamente y constituyen una estructura cristalina lo más compacta posible.
-
Cada átomo se desprende de sus electrones de valencia convirtiéndose en ion positivo.
-
La interacción entre la nube de electrones y los iones positivos asegura la estabilidad del metal. Esta unión constituye el enlace metálico.
Los metales son los elementos más numerosos de la tabla periódica y están situados a la izquierda y en el centro de esta. Así, son metales el sodio, el magnesio, el titanio, el hierro o la plata.