
Son las fuerzas que mantienen unidas a las moléculas (no a los átomos dentro de la molécula, eso lo hacen los enlaces químicos). Aunque son más débiles que los enlaces covalentes o iónicos, determinan propiedades importantes como:
-
Punto de ebullición y fusión
-
Solubilidad
-
Viscosidad
-
Tensión superficial
-
Estados físicos (sólido, líquido, gas)
TIPOS DE FUERZAS INTERMOLECULARES
1. Fuerzas de dispersión de London
(o fuerzas instantáneas dipolo-inducido)
-
Ocurren entre TODAS las moléculas, incluso las no polares.
-
Surgen por movimiento momentáneo de electrones, que crea dipolos temporales.
-
Son débiles, pero se vuelven más fuertes si la molécula es más grande y con más electrones.
Ejemplos:
-
Gases nobles como He, Ne, Ar
-
Moléculas no polares como CH₄ (metano), O₂, N₂
-
Sustancias como yodo sólido (I₂), que se subliman gracias a estas fuerzas
Dato interesante: el gecko puede caminar en
paredes gracias a miles de millones de estas fuerzas
de London actuando en sus patas.
2. Fuerzas dipolo-dipolo
(Van der Waals propiamente dichas)
-
Ocurren entre moléculas polares, con dipolos permanentes.
-
Las zonas positivas y negativas de distintas moléculas se atraen.
-
Más fuertes que las de London, pero menos que los puentes de hidrógeno.
Ejemplos:
-
HCl, SO₂, CH₃Cl
-
El acetona (CH₃COCH₃) tiene punto de ebullición más alto que compuestos similares no polares
Dato interesante: en perfumes o desodorantes, muchas moléculas polares se evaporan a distintas velocidades gracias a estas fuerzas.
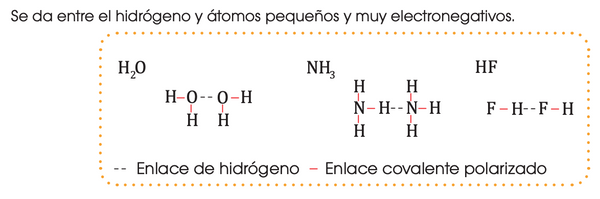
3. Puente de hidrógeno
(hidrógeno enlazado a F, O o N)
-
Es un tipo especial de fuerza dipolo-dipolo muy intensa.
-
Ocurre cuando el hidrógeno está unido a un átomo muy electronegativo:
F (flúor), O (oxígeno), N (nitrógeno). -
El hidrógeno queda con carga parcial positiva y es atraído por un par de electrones libres de otro átomo electronegativo cercano.
Ejemplos:
-
Agua (H₂O): responsable de su alto punto de ebullición
-
ADN: las bases nitrogenadas se unen por puentes de hidrógeno
-
Alcoholes y ácidos carboxílicos también los forman
Dato interesante: El hielo flota porque el agua sólida forma una red estable de puentes de hidrógeno, que deja espacios vacíos → menor densidad que el agua líquida.
Fuerzas de atracción intermolecular

Escanea y mira el video para entender



Dipolo-dipolo: Son fuerzas atractivas que aparecen entre dipolos eléctricos constituidos por moléculas polares. Cuanto mayor es el momento dipolar de las moléculas, mayor es la fuerza atractiva.
Ion-dipolo: Los iones positivos son atraídos hacia el extremo negativo de un dipolo, mientras que los iones negativos son atraídos hacia el extremo positivo. La magnitud de la atracción aumenta al incrementarse la carga del ion o la magnitud del momento dipolar
Click aquí para aprender mucho más

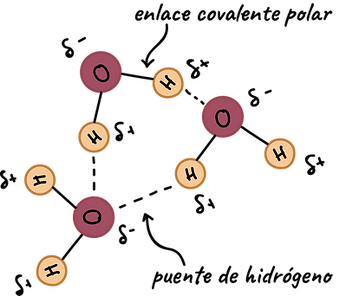


Mira el video para entender
Para aprender más temas de la Química te invito a ir a la Unidad 4. ¡DIVIERTETE!